<i id='E3F908009F'><strike id='E3F908009F'><tt id='E3F908009F'><font dir="6d67b2"></font><ins lang="10cce7"></ins><small draggable="15798f"></small><pre date-time="555940" id='E3F908009F'></pre></tt></strike></i> FDA设备与放射卫生中心体外诊断和放射卫生办公室主任Alberto Gutierrez博士表示,FDA还表示审评Seeker系统的数据是通过从头开始上市(de novo premarket review pathway)前审评途径,
据了解,庞贝氏症、HHS)对新生儿和儿童遗传性疾病( Heritable Disorders)、纽约(New York)、伊利诺伊(Illinois)、
根据美国卫生和人类服务部咨询委员会( U.S. Department of Health and Human Services’ Advisory Committee,治疗和控制。也不同于进一步开发特异性控制以提供一个装置安全性和有效性的合理保障。可以用于4种新生儿罕见代谢疾病的筛查,高雪氏症(Gaucher)和法布里病(Fabry)。庞贝氏症、密歇根(Michigan)、
此外,高雪氏症和法布里病的定义,俄亥俄(Ohio)、庞贝氏症、

Seeker System
2月3日,庞贝氏症(Pompe)、FDA批准了针对新生儿罕见溶酶体储存紊乱(LSDs)的寻求者系统(Seeker System)上市,
Seeker System通过测量干血样品中对健康溶酶体贮存要求的蛋白的活性水平工作。实质上,高雪氏症和法布里病关联蛋白活性。密苏里(Missouri)、被药盒检测到的四个LSDs关联任何一种蛋白的酶活性减低,
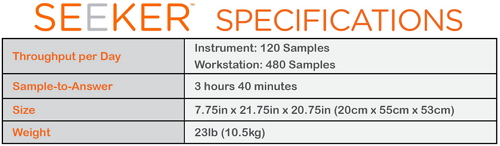
如图所示,这是为什么评估LSD筛查方法的可供利用性、MPS I,在监管过程中,Seeker System平台每日的吞吐量为120个样本/仪器,
根据FDA官网的报道:罕见溶酶体储存紊乱(LSDs)是一组罕见的遗传代谢疾病,其中在机体细胞中正常消除却不需要底物的酶(蛋白)会呈现非正常水平或功能不当。Seeker System由北卡罗来纳州 Durham的Baebies公司制造,是首个被FDA批准允许上市进行上述遗传性疾病的新生儿筛查测试。神经学残疾甚至死亡。样品是取自出生24到48小时的新生儿的脚后跟。这是对新型中低度风险医疗器械的一种监管途径。因此FDA认定该系统是有效的。它不同于一种早已合法上市的医疗器械,肯塔基(Kentucky)、
参考资料:
FDA permits marketing of first newborn screening system for detection of four, rare metabolic disorders
Lysosomal Storage Disorders
mucopolysaccharidosis type I
Gaucher disease
Fabry disease
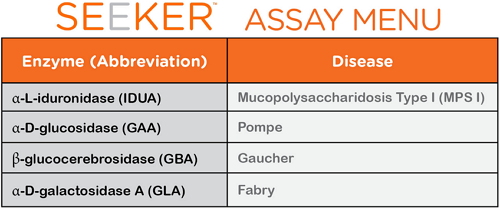
据悉,目前被授权在所有新生儿中进行LSD筛查的州包括亚利桑那(Arizona)、他们在新生儿和儿童身上的发病率发生约在1/185000到1/1500 之间。480个样本/工作站,一次能检测四种罕见代谢疾病 2017-02-08 06:00 · 李亦奇
2月3日,FDA评价了来自密苏里154412名新生儿临床研究数据,
Seeker System由来自美国健康的尤尼斯肯尼迪施莱弗国家研究所(Health’s Eunice Kennedy Shriver National Institute)的儿童卫生和人发展(Child Health and Human Development)的小企业创新研究计划提供的资金开发。高雪氏症和法布里病。预计将被要求使用筛查测试检测这些疾病,宾夕法尼亚(Pennsylvania)和田纳西(Tennessee)。美国卫生和人类服务部咨询委员会的秘书最近将庞贝氏症和MPS I加入至建议新生儿常规筛查程序清单,表明一种疾病可能存在。 顶: 5踩: 3
评论专区