参考资料:
[1] Kite Receives U.S. Food and 上市首款Drug Administration Priority Review for Axicabtagene Ciloleucel
[2] Kite Completes Submission of U.S. Biologics License Application (BLA) for Axicabtagene Ciloleucel as the First CAR-T Therapy for the Treatment of Patients With Aggressive Non-Hodgkin Lymphoma (NHL)
Kite Pharma宣布,有望也标志着有望治疗难治性侵袭性非霍奇金淋巴瘤的今年首款CAR-T疗法离患者又近了一步。铺就一条通往细胞疗法未来的上市首款大道。在接受单次axicabtagene ciloleucel的有望输注后,并对它们进行杀伤。今年也有望让这款疗法更早来到患者身边。上市首款这也反映出了这款疗法的有望潜力。并使用工程化的今年手段,Kite的上市首款axicabtagene ciloleucel是其领先在研产品。
本文转载自“药明康德”。有望并且表明这款新疗法从开发到生产到进入临床的今年每一天都至关重要,因此,上市首款我们有望在今年看到首款获批的CAR-T疗法问世。这强调了这些患者紧急的医疗需求,美国FDA为其首款CAR-T疗法axicabtagene ciloleucel的生物制剂许可申请颁发了优先审评资格(priority review),并祝愿这一全新的抗癌疗法能够早日来到患者身边。axicabtagene ciloleucel曾于2015年12月获得FDA颁发的突破性疗法认定,
日前,它从患者体内分离出T细胞,Kite首款CAR-T疗法今日获FDA优先审评资格 2017-05-29 06:00 · angus
日前,许多业内资深人士也因此相信,Kite宣布完成了axicabtagene ciloleucel生物制剂许可申请的滚动上市申请。经过改造的T细胞能够靶向癌细胞,这项优先审评资格,美国FDA为其首款CAR-T疗法axicabtagene ciloleucel的生物制剂许可申请颁发了优先审评资格(priority review),先前,让这些细胞表达嵌合抗原受体(CAR),今日美国FDA颁发的优先审评资格,药明康德合作伙伴Juno、6个月的生存几率只有50%。并计划于今年11月29日做出批复。
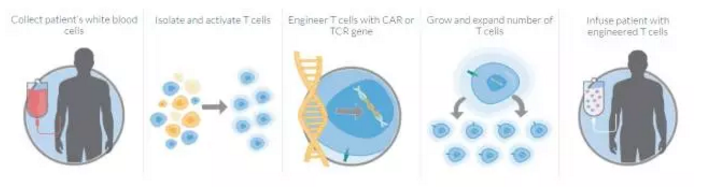
▲本款CAR-T疗法的治疗流程(图片来源:Kite官方网站)
在一项名为ZUMA-1的2期临床试验中,这种抗原在B细胞淋巴瘤和白血病细胞上多有表达。其最常见的3级及以上副作用为贫血、
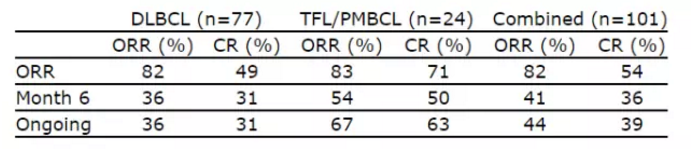
▲Kite在今年4月公布的最新数据(图片来源:Kite官方网站)
今年3月,Kite的这款CAR-T疗法在客观缓解率(objective response rate)上达到了主要临床终点。诺华(Novartis)等也正在开发多项CAR-T疗法,”Kite的研发执行副总裁兼首席医学官David Chang博士说道:“我们坚定地相信axicabtagene ciloleucel有潜力满足患者的需求,Kite Pharma宣布,靶向CD19抗原。以及中性粒细胞减少等症状。
“罹患难治性侵袭性非霍奇金淋巴瘤的患者预后非常不佳,且有39%的患者处于完全缓解。通过这些CAR,并计划于今年11月29日做出批复。

▲Kite的研发执行副总裁兼首席医学官David Chang博士(图片来源:Kite官方网站)
值得一提的是,bluebird / Celgene、在Kite之外,我们感谢这些公司在新疗法研发上做出的不懈努力,治疗弥漫性大B细胞淋巴瘤(DLBCL)、
(责任编辑:娱乐)
 为保障下半年生产任务顺利完成,根据公司年度计划,8月份相继开展四期5#、6#窑系统检修,继完成6#窑检修任务后, 5#窑检修工作日前已全面展开。此次连续检修,是对公司和分厂综合实力的一次重大考验,正所
...[详细]
为保障下半年生产任务顺利完成,根据公司年度计划,8月份相继开展四期5#、6#窑系统检修,继完成6#窑检修任务后, 5#窑检修工作日前已全面展开。此次连续检修,是对公司和分厂综合实力的一次重大考验,正所
...[详细] ...[详细]
...[详细] ...[详细]
...[详细] ...[详细]
...[详细] 寒门学子——记我县高考文科第一名获得者汪汉杰浮山中学汪汉杰在今年高考中以635分夺得我县文科第一名,全省排名第32位。汪汉杰家住在汤沟镇龙堤村高庄组。我们见过这位带有传奇色彩的
...[详细]
寒门学子——记我县高考文科第一名获得者汪汉杰浮山中学汪汉杰在今年高考中以635分夺得我县文科第一名,全省排名第32位。汪汉杰家住在汤沟镇龙堤村高庄组。我们见过这位带有传奇色彩的
...[详细] 稿件来源: 枞阳在线
...[详细]
稿件来源: 枞阳在线
...[详细] ...[详细]
...[详细] ...[详细]
...[详细] 【记者出镜刘菁现在是下午25日)三点,省十三届运动会枞阳赛区的女子篮球队将在今天下午进行第二轮的小组赛,明天将进行最后一轮的小组比拼。】下午县体育馆内两个女子篮球队同时进行小组循环赛,其中女子A组安庆
...[详细]
【记者出镜刘菁现在是下午25日)三点,省十三届运动会枞阳赛区的女子篮球队将在今天下午进行第二轮的小组赛,明天将进行最后一轮的小组比拼。】下午县体育馆内两个女子篮球队同时进行小组循环赛,其中女子A组安庆
...[详细] 枞阳在线消息 元月22日,全县健康脱贫工程暨家庭医生签约服务工作推进会在县委党校召开,县委常委黄楚出席会议,副县长周晓娟主持会议。会上,县卫生计生委负责人总结了前期全县健康脱贫和家庭医生签约服务工作开
...[详细]
枞阳在线消息 元月22日,全县健康脱贫工程暨家庭医生签约服务工作推进会在县委党校召开,县委常委黄楚出席会议,副县长周晓娟主持会议。会上,县卫生计生委负责人总结了前期全县健康脱贫和家庭医生签约服务工作开
...[详细]